Il seme di pesce è il componente più importante per la cultura ittica. Le risorse d'acqua dolce del nostro Paese per l'allevamento ittico sono stimate in 2,85 milioni di ettari di stagni e vasche. In aggiunta a questo, altri 2,05 milioni di ettari di superficie idrica sono disponibili sotto forma di bacini idrici o laghi. È stato stimato che sarebbero necessari quasi 14250 milioni di avannotti per allevare anche l'attuale disponibile di 2,85 milioni di ettari con un tasso di allevamento conservativo di 5000 avannotti/ha. La produzione attuale è di 15007 milioni di avannotti. Oltre a questo, almeno un quantitativo aggiuntivo di 4100 milioni di avannotti è necessario per rifornire l'area disponibile di laghi e bacini artificiali con un tasso medio di allevamento di 2000 avannotti/ha. Ciò indica che è necessario allevare gli avannotti per rifornire le risorse idriche disponibili.
Il seme di pesce è ottenuto da tre fonti:fluviale, vivai e bundh. La raccolta di semi da fonti fluviali era una pratica antichissima. Questo metodo è faticoso e otteniamo la miscela di semi di pesce desiderati e indesiderati. Gli incubatoi sono il modo migliore per ottenere semi di pesce. A parte questi, l'allevamento del bundh è anche un buon metodo per raccogliere il seme del pesce creando un habitat naturale.
I diversi sistemi fluviali dell'India mostrano variazioni per quanto riguarda la distribuzione e l'abbondanza della loro fauna ittica. Ciò è dovuto principalmente alle loro condizioni ecologiche individuali, come gradiente, terreno, flusso, profondità, temperatura, substrati, ecc. I fiumi del nord sono perenni e supportano una ricca pesca commerciale. Fatta eccezione per le regioni deltizie, la pesca dei fiumi peninsulari è scarsa sia nell'alto che nel medio corso.
1 io n du C e D B R eed io n G T e C h no io o G sì
Le carpe si riproducono in acque correnti come i fiumi. Naturalmente non si riproducono mai in acque confinate. Il seme raccolto dalle risorse naturali è generalmente un ceppo misto con varietà desiderabili e indesiderabili. La separazione dei semi desiderabili da ceppi misti è un grosso problema. A causa della manipolazione, le varietà desiderabili possono morire. Se viene trovato qualche seme di pesce predatore, danneggiano il seme di pesce desiderabile. Un altro grosso problema è non ottenere mai il numero richiesto nella raccolta naturale. La disponibilità del seme puro è molto difficile. Per superare tutti questi problemi l'allevamento indotto è un'ottima tecnica per ottenere seme di pesce puro e richiesto. Ha diversi vantaggi. Con l'allevamento indotto si possono ottenere semi puri di specie desiderabili. Supponiamo che il seme di rohu sia necessario, solo il seme di rohu può essere prodotto in un paio di giorni. Con questa tecnica è possibile produrre il numero richiesto di semi. Supponiamo che un allevamento ittico abbia bisogno di 1 seme di pesce crore, questo numero può essere prodotto molto facilmente in meno tempo. I problemi di identificazione e segregazione del seme non si presentano. Questa tecnica è molto semplice. Si possono produrre semi sani. I pesci possono essere generati più di una volta in un anno. L'ibridazione è possibile.
Nelle tecniche di allevamento indotto, quattro tipi principali di materiali sono usati per fare iniezioni ai pesci:estrazioni della ghiandola pituitaria, HCG, ovaprim e ovatide.
Ind tu ce D Allevamento G spirito h Pi T uitar sì Glana D Extra un zio n
L'allevamento di pesci per estrazione della ghiandola pituitaria è un modo efficace e affidabile per ottenere semi puri di pesci coltivabili ed è praticato oggi su scala abbastanza estesa in India e in molti altri paesi del mondo. Si tratta di iniettare a pesci maturi femmine e maschi estratti di ghiandole pituitarie prelevati da altri pesci maturi.
h istori C un io Di ritorno G il giro:
Si dice che l'attuale concetto del ruolo dell'ipofisi nella riproduzione dei vertebrati abbia avuto origine dagli esperimenti di Aschheim e Zondek nel 1927, quando scoprirono che gli impianti ipofisari acceleravano lo sviluppo sessuale delle femmine di topo. Tre anni dopo, nel 1930, Houssay dell'Argentina eseguì il primo esperimento del genere su un pesce. Ha iniettato un piccolo pesce gatto viviparo, Cresterodon decammaculatus con estratti di ghiandola pituitaria preparati da un altro pesce, Prochilodus platensis che determina la nascita prematura di giovani in via di sviluppo. Nel 1934, una tecnica di successo potrebbe essere elaborata da Von Ihring in alcuni pesci da laghetto brasiliani sono stati fatti deporre le uova iniettando loro una sospensione di ghiandole pituitarie fresche raccolte da altre specie di pesci meno pregiate. I brasiliani, così, furono i primi ad utilizzare con successo la tecnica dell'allevamento ittico attraverso l'ipofisi. Nel 1937, Lo scienziato russo Gerbiskii è riuscito a indurre un numero significativo di storioni, Acipenser stellato.
L'India è il terzo paese al mondo a rendere la tecnica parte integrante del suo programma di piscicoltura. Il primo tentativo di ipofisi in India fu fatto da Hamid Khan nel 1937 quando tentò di indurre la deposizione delle uova in Cirrhinus mrigala mediante l'iniezione di ghiandola pituitaria di mammifero. Il tentativo successivo fu fatto da Hussain nel 1945 con alcuni ormoni come 80-120 RV Prolan e Antuitrin-S nella femmina Labeo rohita e Cirrhinus mrigala. Nel 1955, Hiralal Choudhuri è riuscito a indurre la deposizione delle uova in Esomus danricus mediante iniezione intraperitonale di estratto pituitario di Catla catla. Riuscì anche nell'allevamento di Pseudotropius atherinoides. Ramaswamy e Sunderaraj riuscirono a riprodursi in Heteropneustes fossilis e Clarias batrachus rispettivamente nel 1955 e nel 1956. Il primo successo nell'allevamento indotto di carpe maggiori indiane attraverso l'ipofisi è stato ottenuto nel 1957 da Hiralal Chaudhuri e Alikunhi al CIFRI, Tagliata.
Fis h P io tuit un R sì Gla n D :
La ghiandola pituitaria del pesce è un piccolo, corpo morbido e colore bianco crema. È più o meno rotondo nelle carpe. Si trova sul lato ventrale del cervello (Fig. 3.1) dietro il chiasma ottico in una concavità del pavimento della scatola cerebrale, conosciuta come Sella turcica e racchiusa da una sottile membrana chiamata duramater. In pochi pesci è attaccato al cervello da un sottile peduncolo, noto come peduncolo infundibolare. Sulla base del gambo infundibolare, le ghiandole sono classificate in due tipi, vale a dire, platybasic – senza picciolo, hanno un recesso infundibolare aperto e leptobasico – con peduncolo, hanno cancellato il recesso infundibolare. Il tipo leptobasico di ghiandole pituitarie si trova nelle carpe e il tipo platibasico si trova nei channidae e nei nandidae. Le dimensioni e il peso della ghiandola variano in base alle dimensioni e al peso del pesce. A Labeo rohita, il peso medio della ghiandola pituitaria è di 6,6 mg in 1-2 kg di pesce, 10,3 mg in 2-3 kg di pesce, 15,2 mg in pesce di 3-4 kg e 18,6 mg in pesce di 4-5 kg.
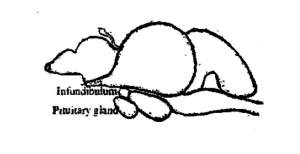
La ghiandola pituitaria secerne gli ormoni gonadotropici, FSH o ormone follicolare stimolante, e LH o ormone luteinizzante. Entrambi gli ormoni vengono secreti durante tutto l'anno, ma la proporzione in cui sono secreti è direttamente correlata al ciclo della maturità gonadica. L'FSH provoca la crescita e la maturazione dei follicoli ovarici nelle femmine e la spermatogenesi nei testicoli dei maschi. LH aiuta a trasformare i follicoli ovarici in corpo luteo nelle femmine e a promuovere la produzione di testosterone nei maschi. Questi ormoni non sono specie-specifici, cioè., un ormone ottenuto da una specie è in grado di stimolare le gonadi di un altro pesce. Però, c'è una grande variabilità nella sua efficacia nelle diverse specie. Gli esperimenti condotti sull'allevamento indotto dei pesci hanno mostrato chiaramente l'efficacia relativa degli estratti dell'ipofisi di pesce sugli ormoni ipofisari dei mammiferi, ormoni sessuali e vari steroidi. Questo è il motivo per cui l'ipofisi del pesce viene ampiamente utilizzata oggi nel lavoro di allevamento di pesci in tutto il mondo.
Collezioni o n o F pituitaria sì Ghiandola :
Il pesce che dona la ghiandola pituitaria cioè, il pesce da cui viene prelevata la ghiandola pituitaria è chiamato pesce donatore. Il successo nell'allevamento indotto di pesci dipende in larga misura dalla corretta selezione del pesce donatore. La ghiandola dovrebbe essere preferibilmente raccolta da pesci gravidi completamente maturi, poiché la ghiandola è più potente al momento della riproduzione o appena prima della deposizione delle uova. La potenza della ghiandola diminuisce dopo la deposizione delle uova. Le ghiandole raccolte da pesci immaturi o esauriti di solito non danno risultati soddisfacenti. Anche le ghiandole dei pesci allevati indotti raccolti immediatamente dopo la deposizione delle uova si sono rivelate efficaci e possono essere utilizzate per l'allevamento di altri pesci. Il periodo più adatto in India per la raccolta delle ghiandole pituitarie delle principali carpe va da maggio a luglio, poiché la maggior parte delle carpe raggiunge stadi avanzati della propria maturità durante questo periodo. Poiché la carpa comune, Cyprinus carpio è un allevatore perenne, i suoi individui maturi si possono ottenere quasi tutto l'anno per la raccolta delle ghiandole. Di solito si preferisce raccogliere le ghiandole da pesci appena uccisi, ma vengono utilizzate anche quelle raccolte da esemplari conservati nel ghiaccio.
Diverse tecniche sono adottate per la raccolta delle ghiandole pituitarie in diversi paesi. In India, la tecnica comunemente adottata per la raccolta delle ghiandole consiste nel recidere il cuoio capelluto del cranio del pesce con un colpo obliquo di un coltello da macellaio. Dopo aver rimosso il cuoio capelluto, la materia grigia e le sostanze grasse che si trovano sul cervello vengono pulite delicatamente con un pezzo di cotone. Il cervello così esposto viene accuratamente sollevato staccandolo dai nervi. Nella maggior parte dei ciprinidi, quando il cervello è sollevato, la ghiandola viene lasciata sul pavimento della scatola del cervello. Il duramater che copre la ghiandola viene quindi rimosso con cautela utilizzando un ago sottile e una pinza. La ghiandola esposta viene quindi prelevata intatta senza causare alcun danno perché le ghiandole danneggiate e rotte provocano la perdita di potenza.
Le ghiandole vengono raccolte anche attraverso il forame magno. È, infatti, un metodo molto più semplice di rimozione delle ghiandole che è comunemente praticato dai professionisti per la raccolta su larga scala in mercati del pesce affollati e rumorosi. In questo metodo di raccolta delle ghiandole, il pesce deve essere essenzialmente decapitato. Nei mercati, le ghiandole vengono raccolte da teste di pesce già tagliate dai rivenditori. Nelle teste di pesce tagliate, il forame è chiaramente visibile da dietro che contiene materia grigia e sostanze grasse. Il cervello si trova sui lati ventrali del forame. Per estrarre la ghiandola, la materia grigia e le sostanze grasse vengono prima rimosse inserendo l'estremità smussata della pinza nel forame ed estraendo l'intera materia senza disturbare il cervello. Il cervello viene sollevato con cautela e spinto in avanti o tirato fuori dal buco. La ghiandola che giace sul pavimento della scatola cerebrale viene quindi prelevata usando un paio di pinzette fini. Un lavoratore sperimentale riesce facilmente a raccogliere circa 50-60 ghiandole in un'ora adottando questa tecnica di raccolta.
P prenotazione o F pituita un R sì Ghiandola S :
Se le ghiandole raccolte non sono destinate all'uso allora e là, devono essere preservati. A causa della loro natura glico- o muco-proteica, sono suscettibili di un'azione enzimatica immediata. Le ghiandole pituitarie possono essere conservate con tre metodi:alcool assoluto, acetone e congelamento. In India si preferisce la conservazione della ghiandola pituitaria del pesce in alcol assoluto. Inoltre, gli esperimenti fatti finora con ghiandole conservate con alcool sulle principali carpe indiane hanno dato risultati più positivi rispetto alle ghiandole conservate con acetone.
Le ghiandole dopo la raccolta vengono immediatamente messe in alcool assoluto per la sgrassatura e la disidratazione. Ogni ghiandola è conservata in una fiala separata contrassegnata in serie per facilitarne l'identificazione. Dopo 24 ore, le ghiandole vengono lavate con alcool assoluto e conservate nuovamente in alcool assoluto fresco contenuto in bottiglie di colore scuro e conservate a temperatura ambiente o in frigorifero. Il cambio occasionale di alcol aiuta a mantenere le ghiandole in buone condizioni per periodi più lunghi. Per evitare che l'umidità penetri all'interno delle fiale, possono essere conservati all'interno di un essiccatore contenente del cloruro di calcio anidro. È preferibile conservare le ghiandole in frigorifero. Si conservano in frigorifero fino a 2-3 anni ea temperatura ambiente fino a un anno.
L'acetone è anche un buon conservante. In questo metodo, subito dopo la raccolta, le ghiandole vengono conservate in acetone fresco o in acetone ghiacciato secco all'interno di un frigorifero a 100 C per 36-48 ore. Durante questo periodo, l'acetone viene cambiato 2-3 volte ad intervalli di circa 8-12 ore per una corretta sgrassatura e disidratazione. Le ghiandole vengono quindi estratte dall'acetone, mettere su una carta da filtro e lasciare asciugare a temperatura ambiente per un'ora. Vengono poi conservati in frigorifero a 100 C, preferibilmente in un essiccatore caricato con cloruro di calcio o altri agenti essiccanti. La conservazione delle ghiandole in acetone è ampiamente praticata in URSS e negli Stati Uniti.
P risarcimento o F pituita R sì Gl un n D E xtrarre :
Le ghiandole conservate vengono quindi pesate. Ciò è essenziale per la determinazione accurata della dose da somministrare in base al peso degli allevatori. Il peso della ghiandola può essere preso individualmente o in gruppo. Per ottenere un peso più preciso, una ghiandola dovrebbe essere pesata esattamente dopo due minuti dalla sua rimozione dall'alcol.
L'estratto ipofisario deve essere preparato appena prima del momento dell'iniezione. La quantità di ghiandola necessaria per l'iniezione viene inizialmente calcolata dal peso per l'allevatore da iniettare. Le ghiandole vengono quindi selezionate e dalle fiale si preleva la quantità necessaria di ghiandole. Si lascia evaporare l'alcol, se le ghiandole sono conservate in alcool. Le ghiandole essiccate con acetone vengono subito prelevate dalle fiale per la macerazione.
Le ghiandole vengono quindi macerate in un omogeneizzatore di tessuti aggiungendo una quantità misurata di acqua distillata o soluzione salina comune o qualsiasi soluzione fisiologica che sia isotonica con il sangue del pesce ricevente. I risultati di maggior successo dell'allevamento indotto nelle carpe maggiori indiane sono stati finora ottenuti con acqua distillata e soluzione salina comune allo 0,3%. La concentrazione dell'estratto è solitamente mantenuta nell'intervallo di 1-4 mg di ghiandola per 0,1 ml del mezzo, cioè, al ritmo di 20-30 g. della ghiandola in 1,0 ml di terreno. Dopo l'omogeneizzazione, la sospensione viene trasferita in una provetta da centrifuga. Durante il trasferimento, l'omogeneizzato deve essere agitato bene in modo che le particelle di ghiandola depositate che si mescolano con la soluzione entrino nella provetta da centrifuga. L'estratto nella provetta viene centrifugato e il liquido surnatante viene aspirato in una siringa ipodermica per l'iniezione.
L'estratto ipofisario può anche essere preparato sfuso e conservato in glicerina (1 parte di estratto:2 parti di glicerina) prima della stagione riproduttiva dei pesci in modo da evitare il fastidio di preparare l'estratto ogni volta prima dell'iniezione. L'estratto di brodo va sempre conservato in frigorifero o in ghiaccio.
T e C h niq tu e o F B ree D ns :
L'operazione di allevamento indotto delle principali carpe viene ripresa quando inizia il monsone regolare, i pesci diventano completamente maturi e la temperatura dell'acqua si abbassa. Le femmine che hanno un giro, addome morbido e rigonfio con sfiato rossastro gonfio e maschi con il latte che trasuda liberamente sono selezionati per la riproduzione. Un riproduttore maschio può anche essere facilmente distinto dalla rugosità sulla superficie dorsale delle sue pinne pettorali.
1 . Fare S ag e o F pitui T ar sì extra un C T :
L'aspetto più importante dell'allevamento indotto dei pesci è la valutazione dei dosaggi adeguati dell'estratto ipofisario. La potenza della ghiandola varia a seconda delle dimensioni e delle fasi dello sviluppo sessuale del donatore, così come le specie del pesce donatore, momento della raccolta delle ghiandole e della loro corretta conservazione. La dose della ghiandola pituitaria è calcolata in relazione al peso degli allevatori da iniettare. È stato anche notato che dosi identiche a riproduttori di peso simile possono dare risultati contraddittori a causa della differenza di maturità delle gonadi. Anche forti dosi di ormoni potrebbero non essere efficaci se le gonadi sono in fase di riassorbimento. Attraverso un'attenta selezione degli allevatori e somministrando un peso noto di estratto di ghiandola pituitaria per kg di peso corporeo degli allevatori, si può ottenere un allevamento di successo.
Esperimenti sulla standardizzazione delle dosi indicano che la somministrazione di una dose preliminare bassa nell'allevatrice seguita da una dose efficace più alta dopo 6 ore si dimostra più efficace di una singola dose knockout. Una singola dose elevata è risultata utile quando gli allevatori sono in condizioni ideali e il clima è favorevole. Rohu risponde bene a due iniezioni mentre catla e mrigal sia a una che a due iniezioni.
Una dose iniziale al ritmo di 2-3 mg. di ghiandola pituitaria per kg di peso corporeo di pesce viene somministrato solo alla femmina allevatrice. Gli allevatori maschi non richiedono alcuna dose iniziale, se trasudano latte con una leggera pressione sull'addome. Due maschi contro ogni femmina formano un set di riproduzione. Per fare un buon set di corrispondenza, il peso dei maschi insieme dovrebbe essere uguale o superiore a quello della femmina. Nel caso in cui la condizione di uno qualsiasi dei due maschi non si trovi nella fase di trasudazione libera, un'iniezione iniziale può essere somministrata al maschio alla velocità di 2-3 mg/kg di peso corporeo. Dopo 6 ore, alla femmina viene somministrata una seconda dose di 5-8 mg/kg di peso corporeo, mentre entrambi i maschi ricevono la prima o la seconda dose alla velocità di 2-3 mg/kg di peso corporeo. Possono essere apportate lievi alterazioni nelle dosi a seconda delle condizioni di maturità degli allevatori e dei fattori ambientali prevalenti. In assenza di equilibrio chimico, 1-3 ghiandole pituitarie sono efficaci per un paio di pesci.
2 . m e Però D o F iniezione :
Le iniezioni intracraniche sono preferite in URSS e intraperitoneali negli USA e in Giappone. L'iniezione intramuscolare è la pratica più comune in India. L'iniezione intramuscolare è meno rischiosa rispetto agli altri metodi. Le iniezioni intraperitoniali vengono solitamente somministrate attraverso le regioni molli del corpo, generalmente alla base della pinna pelvica o talvolta alla base della pinna pettorale. Ma c'è qualche rischio di danneggiare gli organi interni, specialmente le gonadi distese durante la somministrazione di un'iniezione intraperitoniale in pesci completamente maturi.
Le iniezioni vengono solitamente praticate nel peduncolo caudale o nelle regioni della spalla vicino alla base della pinna dorsale. Mentre si fanno iniezioni alle carpe, l'ago viene inserito sotto una squama tenendolo dapprima parallelo al corpo del pesce e poi trafitto ad angolo nel muscolo. Non esiste una regola rigida per quanto riguarda il tempo di iniezione. Le iniezioni possono essere somministrate in qualsiasi momento del giorno e della notte. Ma poiché la bassa temperatura è utile e la notte rimane relativamente più tranquilla, le iniezioni vengono generalmente somministrate nel tardo pomeriggio o nelle ore serali con tempistiche
Seme Produzione T ecnologie 33
così regolato che il pesce è in grado di utilizzare la quiete della notte per deporre le uova indisturbato.
La siringa ipodermica più conveniente utilizzata allo scopo è una siringa da 2 cc con graduazioni di divisione di 0,1 cc. La dimensione dell'ago per la siringa dipende dalle dimensioni degli allevatori da iniettare. L'ago n. 22 è convenientemente utilizzato per carpe da 1-3 kg, Il n. 19 per le carpe più grandi e il n. 24 può essere utilizzato per le carpe più piccole.
L'uso di anestetici durante l'iniezione aumenterebbe significativamente la sopravvivenza dei pesci della covata. Gli anestetici comunemente usati sono MS 222 e Quinaldine. MS 222 può essere aggiunto all'acqua in dosi di 50-100 mg/litro. Un rotolo di cotone imbevuto di 0,04 M di questa soluzione può essere inserito nella bocca del pesce. La chinaldina viene utilizzata in ragione di 50-100 mg/litro.
3 . B rileggere G h ap un un D terme w ning :
Dopo l'iniezione, gli allevatori vengono rilasciati immediatamente all'interno dell'hapa di allevamento. Un hapa da allevamento è generalmente realizzato in tessuto fine delle dimensioni di 3,5 x 1,5 x 1,0 m per gli allevatori più grandi e 2,5 x 1,2 x 1,0 m per gli allevatori di peso inferiore a 3 kg. Tutti i lati dell'hapa di allevamento sono cuciti e chiusi ad eccezione di una parte in alto per l'introduzione degli allevatori all'interno. In genere, un gruppo di allevatori viene rilasciato all'interno di ogni hapa di allevamento, ma a volte, per risparmiare sul materiale ipofisario, si tenta anche l'allevamento in comunità riducendo il numero di riproduttori maschi. Dopo il rilascio del pesce, l'apertura dell'hapa è ben chiusa in modo che gli allevatori non possano saltare fuori e fuggire. Invece di hapas, cisterne di cemento o piscine di plastica grandi come hapas possono essere utilizzate anche per l'allevamento.
La deposizione delle uova avviene normalmente entro 3-6 ore dopo la seconda iniezione. Subito dopo la fecondazione, le uova si gonfiano notevolmente a causa dell'assorbimento di acqua. Le uova fecondate delle principali carpe appaiono come brillanti perle di vetro di trasparenza cristallina mentre quelle non fecondate appaiono opache e biancastre. La dimensione delle uova della stessa specie di allevatori diversi varia considerevolmente. Le uova completamente gonfie delle principali carpe indiane misurano 2,5 mm di diametro, il più grande è quello di catla e il più piccolo di rohu. Le uova di carpa sono di tipo non galleggiante e non adesivo. Il tuorlo non possiede globuli oleosi. Le principali carpe indiane hanno un'abbondante capacità di deposizione delle uova. la loro fecondità, in media, è 3,1 lakh in rohu, 1-3 lakh in catla e 1,5 lakh in mrigal.
Le uova in via di sviluppo vengono conservate indisturbate nell'hapa di allevamento per un periodo di almeno 4-5 ore dopo la deposizione delle uova per consentire alle uova di indurirsi adeguatamente. Dopodichè, le uova vengono raccolte dall'hapa usando una tazza e trasferite in un secchio con una piccola quantità d'acqua. Gli allevatori vengono quindi prelevati e pesati per scoprire la differenza prima e dopo la deposizione delle uova. Questo dà un'idea della quantità di uova deposte. Il volume totale e il numero di uova possono essere facilmente calcolati dal volume noto e dal numero di uova della tazza campione. Anche la percentuale di uova fecondate viene valutata di conseguenza effettuando un campionamento casuale prima e dopo la deposizione delle uova. Questo dà un'idea della quantità di uova deposte. Il volume totale e il numero di uova possono essere facilmente calcolati dal volume noto e dal numero di uova della tazza campione. Anche la percentuale di ovuli fecondati viene valutata di conseguenza effettuando un campionamento casuale.
4 . S trio P spillo G :
Le carpe cinesi, tuttavia, non si riproducono naturalmente e quando si generano, la percentuale di fertilizzazione è generalmente molto bassa. Si segue quindi lo stripping (Fig. 3.1) o l'inseminazione artificiale. Il pesce femmina è tenuto con la testa inclinata verso l'alto e la coda in basso e il ventre rivolto verso il vaso, e le uova vengono raccolte in un trogolo di smalto o plastica premendo il corpo della femmina. Il pesce maschio viene quindi tenuto in modo simile e il latte viene spremuto nello stesso trogolo. I gameti vengono poi mescolati il prima possibile per mezzo di una piuma d'oca per consentire la fecondazione. Le uova fecondate vengono poi lavate un paio di volte con acqua pulita per eliminare il latte in eccesso e lasciate indisturbate in acqua dolce per circa 30 minuti. Le uova sono quindi pronte per il rilascio nelle vasche di schiusa.

T e chn io qui e o F h un tch io n G T h e e ggs :
Le uova raccolte dalle hapa da riproduzione vengono trasferite nelle hapa da cova. Un hapa da cova consiste di due pezzi separati di hapas, l'hapa esterno e l'hapa interno. L'hapa interno è di dimensioni più ridotte ed è inserito all'interno dell'hapa esterno. L'hapa esterno è costituito da un telo sottile nelle dimensioni standard di 2 x 1 x 1 m mentre l'hapa interno è costituito da un telo per zanzariera a maglie rotonde delle dimensioni di 1,75 x 0,75 x 0,5 m. Tutti gli angoli delle hapas esterno ed interno sono provvisti di passanti e corde per facilitare l'installazione. Circa 75, 000 a 1, 00, 000 uova sono distribuite uniformemente all'interno di ogni hapa interno. Le uova si schiudono in 14-20 ore ad un intervallo di temperatura di 24-310 C. Il periodo di incubazione, infatti, è inversamente proporzionale alla temperatura. Dopo la schiusa, i piccoli scappano nell'hapa esterno attraverso le maglie dell'hapa interno. L'hapa interno che contiene i gusci delle uova e le uova morte che vengono rimosse quando la schiusa è completa. I piccoli rimangono indisturbati nell'hapa esterno fino al terzo giorno dopo la schiusa. Durante questo periodo, si nutrono del cibo immagazzinato nel sacco vitellino. Entro il terzo giorno si forma la bocca e i piccoli iniziano il movimento direttivo e l'alimentazione. In questa fase vengono accuratamente raccolti dall'hapa da cova esterna e stoccati in vivai preparati.
È stato scoperto che le principali carpe indiane potrebbero essere indotte a deporre le uova due volte nella stessa stagione con un intervallo di due mesi. Gli allevatori dopo la prima deposizione delle uova vengono nutriti con panelli di arachidi e crusca di riso in rapporto 1:1 al 2,5 percento del peso corporeo. Quando si verificano condizioni climatiche favorevoli, maturano e sono pronti per la deposizione delle uova.
In D uce D Br e edin G w io T h H.C. G .
Oggi l'estrazione della ghiandola pituitaria è una tecnica consolidata per l'allevamento indotto in tutto il mondo. Il suo uso su larga scala pone i seguenti problemi per quanto riguarda la disponibilità e la qualità della ghiandola pituitaria (P.G). Inadeguata fornitura di P.G., costo alto, variabilità della potenza della gonadotropina ipofisaria e imbrogli da parte di P.G. fornitori. Per superare questi problemi, La gonadotropina corionica umana (H.C.G) è stata trovata come alternativa alla ghiandola pituitaria. H.C.G. fu scoperto all'inizio del 1927 da Aschheim e Zondek. Hanno estratto un ormone di buona qualità con attività gonadotrofica luteinizzante dall'urina delle donne in gravidanza. I lavoratori russi usarono per la prima volta la gonadotropina corionica nel 1964 con un nome commerciale come Choriogohin e ottennero buoni risultati su Loach. Bratanor (1963) e Gerbilski (1965) usarono l'H.C.G su carpe e trote e ottennero un grande successo. Tang (1968) ha affermato che quando le carpe cinesi sono state trattate con l'ipofisi di pesce in combinazione con C.G., l'efficacia sull'allevamento indotto è aumentata. Un esame della letteratura indica che H.C.G. è efficace da solo o in combinazione con P.G. estratto nell'indurre vari pesci in tutto il mondo.
H.C.G. è una glicoproteina o sialoproteina, a causa delle molecole di carboidrati attaccate alle molecole proteiche. La sua funzione primaria è quella di mantenere la produzione di estrogeni e progesterone da parte del corpo luteo. È prodotto dalla placenta ed escreto attraverso le urine durante le prime fasi della gravidanza (2-4 mesi). HCG comprende 2 subunità a e b e ha una dimensione molecolare di 45, 000-50, 000 dalton. Ci sono 17 amminoacidi in esso, di cui alanina, prolina, serina, la cistina e l'istidina sono importanti. A causa del gran numero di amminoacidi, H.C.G. ha un alto contenuto proteico. Il peso molecolare è stato riportato come 59, 000 mediante filtrazione su gel e 47, 000 per equilibrio di sedimentazione.
Durante le prime fasi della gravidanza H.C.G. è ricco nelle urine delle donne in gravidanza. Diversi metodi sono impiegati per l'estrazione di H.C.G. Aschheim e Zondek (1927) usarono l'etanolo per la precipitazione. Katzman e Caina hanno usato assorbenti diversi. L'estrazione commerciale di HCG grezzo viene effettuata con filtrazione su gel.
L'ormone follicolo-stimolante (FSH) e l'ormone luteinizzante (LH) dell'ipofisi svolgono un ruolo importante nella normale riproduzione dei pesci, cioè, nel promuovere lo sviluppo delle gonadi, crescita, maturità e riproduzione. HCG è più o meno simile per carattere e funzione a F.S.H e L.H. Poiché la ghiandola pituitaria viene utilizzata per l'allevamento di pesci indotto, L'H.C.G può essere utilizzato anche per la maturazione precoce delle gonadi. La superiorità di H.C.G su P.G può essere misurata per i seguenti motivi. Il pesce raggiunge la maturità più velocemente con H.C.G., la deposizione delle uova della stagione riproduttiva può essere aumentata con H.C.G., H.C.G. garantisce una migliore sopravvivenza delle uova, riduce l'intervallo di tempo tra le dosi preparatorie e finali, HCG è più economico e ha una lunga durata, HCG è facilmente disponibile da una fonte standard, quindi è più affidabile, le iniezioni periodiche di H.C.G durante tutto l'anno garantiscono una salute migliore e un aumento del peso e dello sviluppo delle gonadi La potenza dell'H.C.G è nota (30 UI/ mg), disponibile in pacchi ordinati di peso noto, non si tratta di conservazione, non può essere falso, I pesci trattati con HCG possono essere utilizzati più di una volta per l'allevamento indotto nella stessa stagione, il tasso di mortalità dei piccoli è trascurabile, il consumo del farmaco è minore durante gli allevamenti indotti, L'H.C.G può essere utilizzato come ormone della crescita e l'assorbimento delle uova alla fine della stagione riproduttiva è relativamente minore con la somministrazione di H.C.G.
L'H.C.G grezzo è in polvere e di colore bianco grigiastro o giallo chiaro. Si scioglie facilmente in acqua. La quantità calcolata di H.C.G grezzo viene prelevata in un omogeneizzatore di tessuti e agitata per 5-10 minuti con acqua distillata dosata. Si centrifuga per 3-5 minuti. Il liquido supernante giallastro chiaro con gli ormoni HCG viene prelevato e iniettato immediatamente. Qualsiasi ritardo nell'uso comporterà la perdita della potenza.
In caso di carpa argentata (Hypophthalmichthyes molitrix), l'uso di H.C.G è risultato abbastanza efficace. Il dosaggio è di 4-6 mg/kg. peso corporeo del maschio, e 6-8 mg/kg di peso corporeo della prima dose e dopo circa 6-7 ore, 10-12 mg/kg di peso corporeo della seconda dose per la femmina che ha dato buoni risultati. L'uso del solo H.C.G nell'allevamento delle principali carpe indiane non ha finora dato risultati positivi. Una combinazione di 60-80% H.C.G e 40-20% P.G per le principali carpe e graminacee indiane (Ctenopharyngodon idella) ha successo. I pesci che sono indotti a riprodursi con il solo H.C.G sono i cefali, Ciprino carpio, Lctalurus punctatus, Oreochromis nilotica, Aristhys nobilis, Misgurnus fossilis, Esox lucius e Epinephelus tauvina.
Lavori recenti mostrano che la combinazione di H.C.G e P.G. è più raccomandabile di H.C.G o P.G da soli. È necessario lavorare di più per standardizzare il dosaggio di H.C.G per l'allevamento indotto delle principali carpe e delle carpe cinesi.
In D uce D Bree D in G w esso h oh vapr io m
A causa del problema della variazione della potenza dell'ipofisi, sono state provate alternative. Sono stati fatti tentativi in vari paesi di utilizzare gli analoghi degli ormoni luteinizzanti - ormoni di rilascio (LH-RH) per l'allevamento indotto di pesci con vari gradi di successo. Però, il successo ottenuto con LH-RH non è stato sempre coerente, a parte il suo fabbisogno di dosi più elevate per l'induzione della deposizione delle uova. Questa indagine epocale ha aperto la strada allo sviluppo di una tecnologia semplice ed efficace per l'allevamento indotto della maggior parte dei pesci coltivabili. In un progetto di collaborazione congiunto, finanziato dall'International Development Research Centre, Canada al Dr. Lin della Cina e al Dr. Peter del Canada, sono state effettuate una serie di indagini per sviluppare una tecnologia affidabile per l'allevamento dei pesci. Le loro indagini hanno portato allo sviluppo di una nuova tecnica chiamata metodo "LNPE", in cui un analogo di LH-RH è combinato con un antagonista della dopamina. In base al principio, M/s Syndel Laboratories Limited, Il Canada ha prodotto un nuovo farmaco chiamato ovaprim.
Ovaprim è un prodotto pronto all'uso e la soluzione è stabile a temperatura ambiente. Contiene un analogo di 20 µg dell'ormone di rilascio della gonadotropina di salmone (sGnPHa) e un antagonista della dopamina, domperidone a 10 mg/ml. La potenza di ovaprim è uniforme e contiene sGnRHa che è noto per essere 17 volte più potente di LH-RH (Peter, 1987). L'antagonista della dopamina, è anche riportato che il domperidone utilizzato in ovaprim è migliore di un altro antogonista comunemente usato, pimozide. Ovaprim essendo un prodotto pronto all'uso e che non necessita di conservazione refrigerata, sembra essere l'agente di ovulazione più conveniente ed efficace.
Questo farmaco viene somministrato contemporaneamente a una nidiata sia di femmine che di maschi in una singola dose, a differenza dell'estratto pituitario che viene somministrato in due dosi separate. Ciò riduce non solo la manipolazione dei pesci da covata, ma aiuta anche a risparmiare una notevole quantità di tempo e lavoro che si aggiungerà al costo della produzione di semi. La risposta alla deposizione delle uova nelle specie trattate risulta essere superiore alle specie iniettate con estratto ipofisario.
L'efficienza dell'ovaprim per l'allevamento indotto di carpe ha dato risultati molto incoraggianti in catla, rohu, mrigal, carpa d'argento, carpa erbivora, testa grande, etc. The effective dose required for various species of carps is found to vary considerably. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. In India, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
In D uce D fratello e edin G w io T h o vati D e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Ind tu ce D B reedin G spirito h Ovop e io
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Però, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, in India, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). In India, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
oh T lui R Su B personale n ce S noi e D F o R io n dotto e D B R eee D in G
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R h analo G ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S T e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl o miph e no :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E S T io m un T io o n o F E G G S :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B R ead io n G o F C o m più n C ar P :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 a 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.